Du lernst hier, wie du aus Rotkohl eine einfache Indikatorlösung herstellst, die dir mit klarer Farbe anzeigt, ob eine Probe sauer, neutral oder basisch ist.
Kochen Sie das Gemüse in heißem wasser, bis die Flüssigkeit rötlich‑violett wird. Diese Lösung reagiert sichtbar: bei pH 2 rot, pH 4 lila, pH 6 blauviolett, pH 7–8 blau, pH 10 blau‑grün und pH 12 grünlich‑gelb.
Die Ursache sind Anthocyane: in saurer Umgebung sind sie protoniert, in basischer deprotoniert. Das ändert die absorbierte und reflektierte Farbe.
Praxis: Du kannst Essig, Seifenwasser oder Limonade prüfen, die Lösung ein paar Tage kühlen oder einfrieren und so für weitere Versuche aufbewahren.
Sicherheit: Achte auf Verbrühungen beim Abgießen und vermeide Hautkontakt mit starken Basen wie Rohrreiniger, da diese sehr alkalisch und gefährlich sind.
Überblick: Was du mit Rotkohlsaft als Indikator lernst
Mit einfachem Rotkohlsaft kannst du den pH‑Wert haushaltsüblicher Flüssigkeiten sichtbar machen. Das ist ein schnelles, klares Experiment, das nur wenig Zeit und normales Wasser verlangt.
Die Lösung zeigt die Farbe jeder getesteten Flüssigkeit: von sauren Proben wie Essig bis zu basischen Haushaltsreinigern. Die Ursache sind Anthocyane, die ihre Struktur und damit die Absorption je nach pH ändern.

- Du verstehst pH‑Werte anschaulich durch sichtbare Farbumschläge.
- Typische Proben: Essig, Zitronensaft, Seifenwasser, Limonade.
- Kein Labor nötig: nur Küche, Topf und Glas.
- Im Garten zeigt Blaukraut ähnliche Farbvariationen je nach Boden‑pH.
- Du lernst, Farben zu beobachten und sinnvoll zu interpretieren.
| Probe | Erwartete Farbe | pH‑Bereich (grob) |
|---|---|---|
| Essig | rötlich | 2–3 |
| Limonade | lila bis blau | 3–5 |
| Seifenwasser | blau bis grünlich | 8–10 |
| Starke Lauge | grünlich‑gelb | 11–13 |
Fazit: Dieses einfache Verfahren macht Chemie alltagsnah und sicher erfahrbar. In den folgenden Abschnitten zeige ich dir Schritt für Schritt, wie du die Lösung herstellst und korrekt anwendest.
Rotkohl Indikator: Schritt-für-Schritt zur pH-Indikatorlösung
Du richtest in der Küche ein einfaches Setup ein: ein Stück rotkohl, heißes wasser, ein Topf sowie ein hitzefestes glas. So bereitest du eine gebrauchsfertige Lösung vor.
Materialien und Küchen‑Setup
- Stück Kohl, Messer, Schneidebrett
- Topf, Sieb, sauberes Glas oder Flasche
- Kaffeefilter für Indikatorpapier
Sicherheit zuerst
Zieh Handschuhe oder Topflappen an. Gieße langsam ab, um Verbrühungen zu vermeiden. Schütze Kleidung vor Flecken.
Vorbereitung und Auskochen
Zerkleinere einige Blätter und koche sie in heißem Wasser, bis das Sud rötlich‑violett ist. Siebe die Feststoffe ab, dann fängst du die klare lösung auf.
Aufbewahrung & Indikatorpapier
Fülle die Flüssigkeit in ein Glas, beschrifte es mit Datum. Im Kühlschrank hält sie einige Tage; du kannst einen Teil einfrieren.
Tränke Kaffeefilter mit Rotkohlsaft, lass ihn vollständig trocknen und schneide Streifen. Für einen Schnelltest gibst du etwas Rotkohlsaft in ein Glas und träufelst ein paar Tropfen der Probe, z. B. essig, hinzu. Beobachte den Farbumschlag.
„Arbeit sauber und vergleichbar: gleiche Gläser und Lichtbedingungen helfen beim sicheren Ablesen.“
| Schritt | Was du brauchst | Ergebnis |
|---|---|---|
| Zerkleinern | Messer, Brett | Mehr Oberfläche für Extrakt |
| Kochen | Topf, wasser | rötlich‑violette Flüssigkeit |
| Abseihen | Sieb, glas | klare Indikatorlösung |
| Indikatorpapier | Kaffeefilter, Teller | Trockene Teststreifen |

Experimente mit Säuren & Basen: Von Essig-Test bis Regenbogen-Gläser
Bereite ein kleines Experiment vor, das Säuren und Basen mit klaren Farbwechseln sichtbar macht. Du arbeitest mit einfachen Zutaten und beobachtest, wie sich die farbe der lösung ändert.
Schnelltest im Glas
Gib etwas rotkohlsaft in ein transparentes glas. Füge ein paar Tropfen essig oder Seifenwasser hinzu und schaue sofort zu. Der Farbumschlag zeigt dir auf einen Blick, ob die Probe sauer oder basisch ist.
Regenbogen‑Flüssigkeiten
Stelle sieben identische Gläser halbvoll mit wasser. Gib nacheinander 2 EL Zitronensaft, 2 EL Essig, 2 EL Limonade, nichts, 1 TL Backpulver, 1 TL Waschpulver und etwas Spülmittel oder 1 TL Rohrreiniger hinein.
Fülle die Gläser mit Indikator auf und beobachte die Reihe von rot über violett bis grünlich‑gelb.

Interpretation der Farben
Rot steht für sehr sauer, lila bis blauviolett für nahe neutral und blau bis grünlich‑gelb für basisch. So ordnest du unbekannte flüssigkeiten in grobe pH‑Bereiche ein.
Hinweise zu starken Laugen
Sei vorsichtig: Spülmittel kann neutral sein, Rohrreiniger aber sehr ätzend. Trage Handschuhe, vermeide Hautkontakt und entsorge Reste sicher.
„Dokumentiere die Farben und Beschriftungen – das macht Vergleiche später viel leichter.“
Hintergrundwissen: Anthocyane, pH-Wert und warum sich die Farbe ändert
Anthocyane sind weit verbreitete Pflanzenfarbstoffe. Sie stecken in Blättern und Früchten und geben der Extraktlösung aus Rotkohl oder Blaukraut ihre typische Reaktionsfähigkeit.
Als Farbstoff reagieren Anthocyane empfindlich auf den pH‑Wert. In saurer flüssigkeit sind sie protoniert; das verändert die Elektronenverteilung. In basischer Umgebung deprotonieren sie und verschieben die absorbierte Wellenlänge.
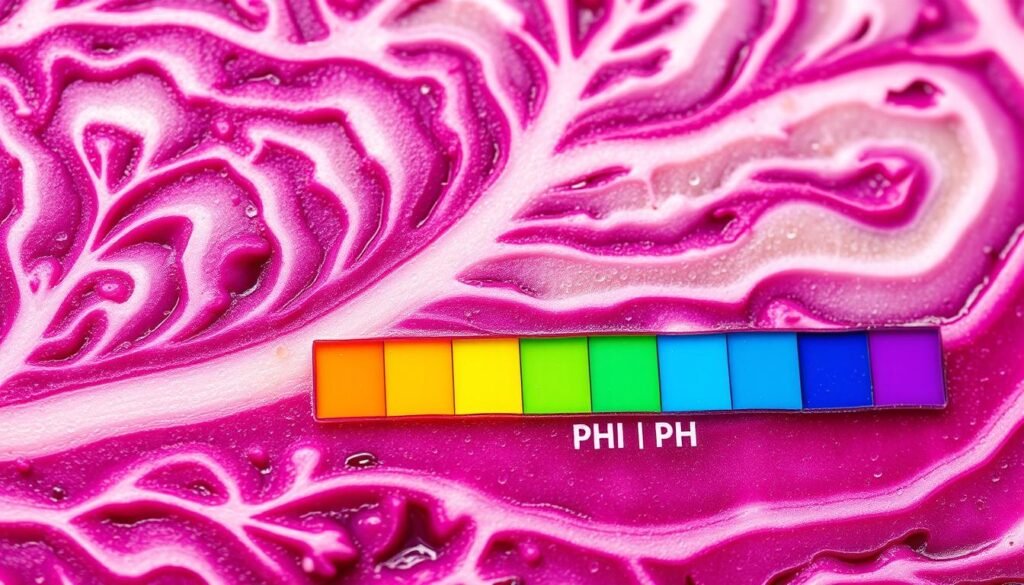
Das erklärt die typische pH‑Skala der Indikatorlösung: rot ≈ pH 2, lila ≈ pH 4, blauviolett ≈ pH 6, blau ≈ pH 7–8, blau‑grün ≈ pH 10 und grünlich‑gelb ≈ pH 12. Reines wasser hat pH 7; Haut liegt meist leicht sauer (
- Strukturänderung: Protonierung/Deprotonierung verändert die Farbigkeit.
- Alltagsbezug: Blaukraut zeigt je nach Boden‑pH unterschiedliche Töne.
- Praxis: Nutze diese Farbskala, um Proben besser einzuordnen.
- Beobachtungstip: Konzentration, Licht und Gefäßfarbe beeinflussen die wahrgenommene Farbe.
Wenn du die pH‑Farbtabelle neben deinen Proben legst, kannst du Ergebnisse zuverlässig dokumentieren und Abweichungen leichter erklären. Für tieferes Hintergrundwissen siehe den Beitrag zur Chemie blauer Blütenfarben: Blütenblau: Chemie eines wechselhaften Farbstoffs.
Tipps für gelungene Ergebnisse und häufige Fehlerquellen
Mit wenigen Handgriffen verbesserst du die Sichtbarkeit feiner Farbumschläge deutlich. Achte zuerst auf die Konzentration der Lösung: etwas länger auskochen oder weniger wasser nehmen, damit die farbe kräftiger wird, aber nicht trüb.

Klare Farben erzielen: Konzentration, Glaswahl und Licht
Verwende klare, farblose Gläser und natürliches Licht. So erkennst du Unterschiede zwischen violett, blau und blau‑grün sicher.
Arbeite vergleichbar: gleiche Volumina und Mischverhältnisse helfen, Effekte von backpulver oder Natron reproduzierbar zu beurteilen.
„Beschrifte jedes Glas und notiere die Menge der zugegebenen Substanz — das macht deine Ergebnisse verwertbar.“
| Problem | Ursache | Lösung |
|---|---|---|
| Blasse Farbe | zu dünne Lösung | konzentrieren oder frischen Sud ansetzen |
| Verfälschte Tests | Kontamination | Pipetten/ Löffel getrennt nutzen und Gläser beschriften |
| Unklare Einordnung | schlechtes Licht oder gefärbtes Glas | klare Gläser, natürliches Licht wählen |
Lagerung: Restmengen dunkel im Kühlschrank aufbewahren oder portionsweise einfrieren. Du kannst auch Kaffeefilter in Rotkohlsaft tränken und als trockenes Testpapier nutzen.
Sicherheit: Arbeite bei starken Laugen mit Handschuhen. Vermeide Hautkontakt und spüle verschüttete Tropfen sofort mit viel wasser.
Für weiterführende Hinweise zu Säure‑Base‑Gleichgewichten und kindgerechten Experimenten siehe die ausführliche Anleitung zur Chemie und praktische Versuche: Säure‑Base‑Gleichgewichte und Experimente für Kinder.
Fazit
Zum Abschluss siehst du, wie einfach sich pH‑Werte mit Küchenmitteln sichtbar machen lassen. Mit etwas rotkohl und Wasser erhältst du eine praktische lösung, die dir durch klare farbe anzeigt, ob eine Probe sauer oder basisch ist.
Die Grundlage sind Anthocyane; bei Säuren und Laugen ändert sich ihre Struktur und damit die Tonfolge von rot bis grünlich‑gelb. Auch blaukraut zeigt dieselben Effekte.
Du weißt nun, wie du das experiment sicher planst, wiederholbar dokumentierst und typische Fehler vermeidest. Hol den Kohl, setz den Sud an und vergleiche die Farben — so wird Chemie lebendig und nachvollziehbar.


